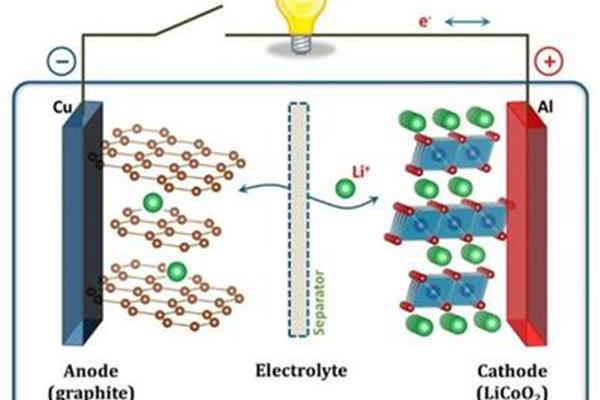
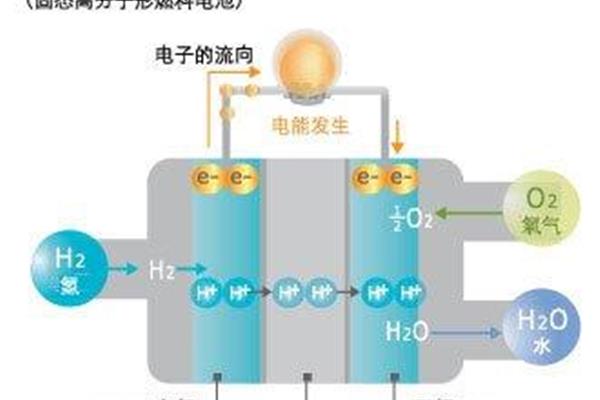
铅酸电池的原理 水果电池的原理
什么是原创电池的原理?电动车的电池原理是什么?一些原电池可以形成可逆电池,而另一些则不能。充电电池的原理我们先来说说电池的放电过程,首先,电池是一种将化学能转化为电能的装置,原电池原理原电池的原理是通过氧化还原反应产生电流,也可以说是将化学能转化为电能,到底是什么原电池电池的原理 ①原电池的工作原理是氧化还原反应分为正(还原)极和负(氧化)极,负极上失去的电子流入正极,从而产生电流。
铅蓄电池中的阳极(PbO₂)和阴极(Pb)浸在电解液(稀硫酸)中,两者之间会产生2V的电力。这是基于铅蓄电池的原理。充放电后,正极、负极、电解液会发生如下变化:(正极)(电解液)(负极)PBO2HsoPbsO2hoPbSO(放电反应)。(二氧化铅)(硫酸)(海绵铅)PbO₂中Pb的价态降低,被还原,负电荷流动;海绵铅中Pb的价态增加,正电荷流动。

第一硫酸铅中的铅的价态上升,被氧化,正电荷流入正极;第二硫酸铅中的铅的价态被还原,负电荷流入负极。1.放电过程中的化学变化:当电池接入外电路放电时,稀硫酸会与正负极板上的活性物质发生反应,生成新的化合物硫酸铅。硫酸成分通过放电从电解液中释放出来,放电时间越长,硫酸浓度越稀。消耗的成分与排放量成正比。只要测量电解液中硫酸的浓度,即测量其比重,就可以知道排放量或残留量。
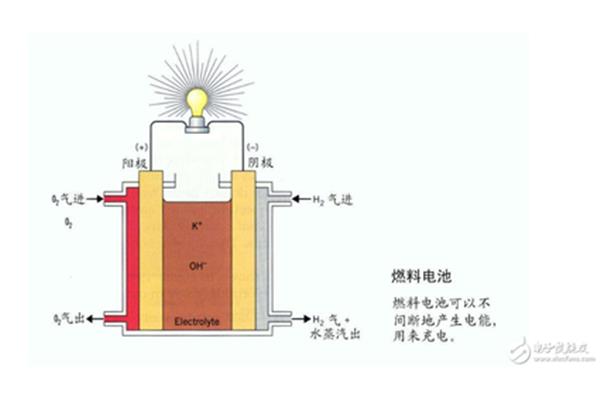
电池内部一般是22 ~ 28%的稀硫酸。当电池直立放置时,电解液可以淹没电极板,还有一点空间。如果将电池水平放置,部分电极板会暴露在空气中,对电池的电极板非常不利。而且电池的观察孔或电池顶部有排气口与外界相通,所以电池横放时电解液容易流出。电池是电池的一种,它的作用是把有限的电能储存起来,用在正确的地方。
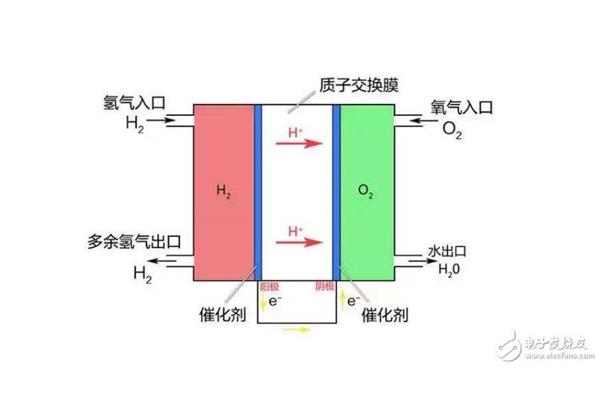
它以填充有海绵铅的铅板为负极,填充有二氧化铅的铅板为正极,以22-28%的稀硫酸为电解液。充电时电能转化为化学能,放电时化学能转化为电能。电池放电时,金属铅为负极,发生氧化反应,被氧化成硫酸铅;二氧化铅是正极,经过还原反应,还原成硫酸铅。当电池用直流电充电时,铅和二氧化铅分别在两极生成。去掉电源后,又恢复到放电前的状态,形成化学电池。
①原电池的工作原理是氧化还原反应分为正(还原)极和负(氧化)极,负极上失去的电子流入正极,从而产生电流。②进出正负极的电子总数相等。根据电子守恒,进出正负两极的电子总数相等。根据电子守恒原理,可以进行许多关于电极反应的计算。该原理可用于计算许多电极反应。③原电池反应与直接反应的区别:原电池反应与直接反应的区别:反应速度加快;
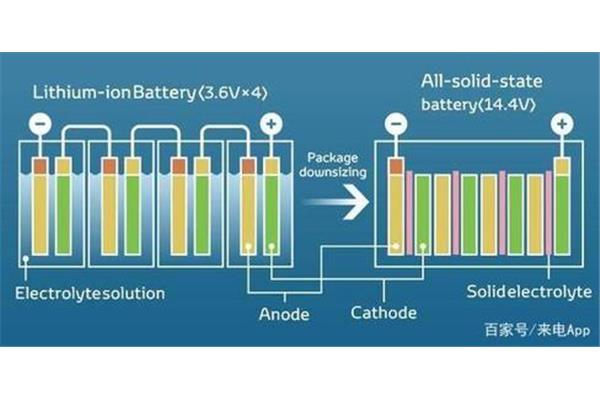
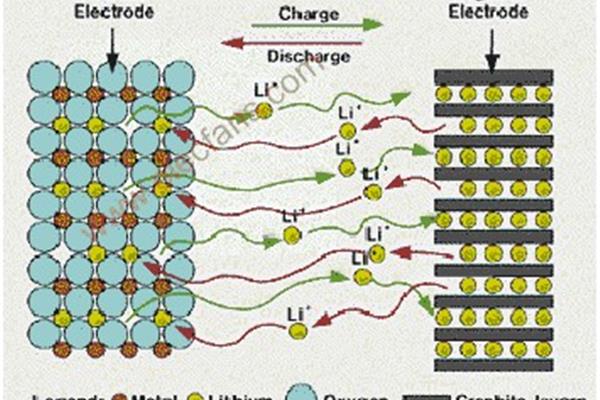
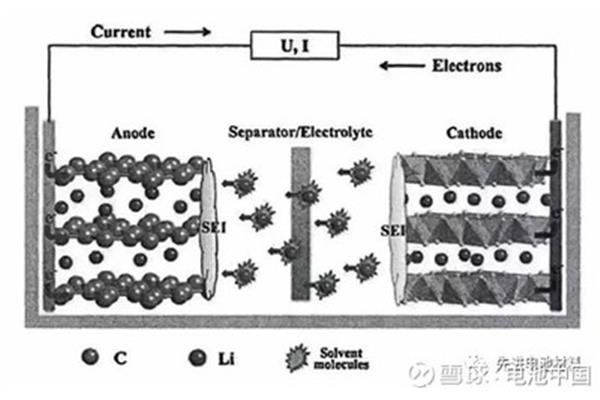
充电电池有五种,分别是镍镉、镍氢、锂离子、锂聚合物和铅酸电池。Ni-Cd:有记忆效应的小容量,Ni-MH:有记忆效应的小容量,Li-ion:无记忆效应的薄容量。由于电极材料不同,电动势为3.6V和3.7V..锂电池的性能是现有各种电池中最好的,体积小,重量轻,容量大。广泛应用于数码相机、笔记本电脑、手机等电子产品。铅蓄:电动势2V左右,铅蓄电池可以反复充电。电解液为硫酸溶液,内阻小,广泛用于汽车、摩托车。
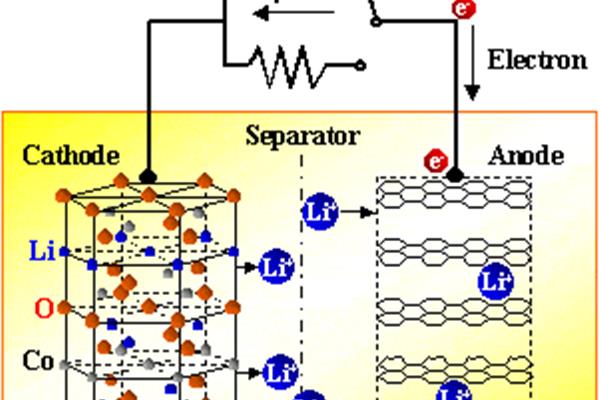
工作原理:先说电池的放电过程。电池是一种将化学能转化为电能的装置。以锌铜一次电池为例:┏锌片:Zn–2 ezn 2氧化反应(负极)e┗铜片:2H2还原反应(正极)通式:Zn 2H2Zn2H2 ╹这是电池的放电过程(两种活性不同的物质之间的电子转移)。
说说电池的放电过程。首先,电池是一种将化学能转化为电能的装置。以锌铜一次电池为例:┏锌片:Zn–2 ezn 2氧化反应(负极)e┗铜片:2H2还原反应(正极)通式:Zn 2H2Zn2H2 ╹这是电池的放电过程(两种活性不同的物质之间的电子转移)。发生条件:①两个活性不同的电极(金属与金属或石墨或不溶性金属氧化物);(2)将两个电极浸入电解质溶液中,导线连接或直接接触;粒子的放电顺序:阳离子:K,Ca2,Na,Mg2,Al3,Zn2,Fe2 Sn2,Pb2 (h) CuFe2Hg2 Ag(得到E的能力依次增大)阳离子:除Au和Pt以外的金属作为电极的放电能力大于阴离子。

原电池的原理是通过氧化还原反应产生电流,也可以说是将化学能转化为电能。一些原电池可以形成可逆电池,而另一些则不能。当一次电池放电时,负电极经历氧化反应,正电极经历还原反应。比如铜锌原电池也叫丹尼尔电池,其正极是铜电极,浸在硫酸铜溶液中;负电极是浸在硫酸锌溶液中的锌板。两种电解质溶液通过盐桥连接,两个电极通过导线连接形成一次电池。
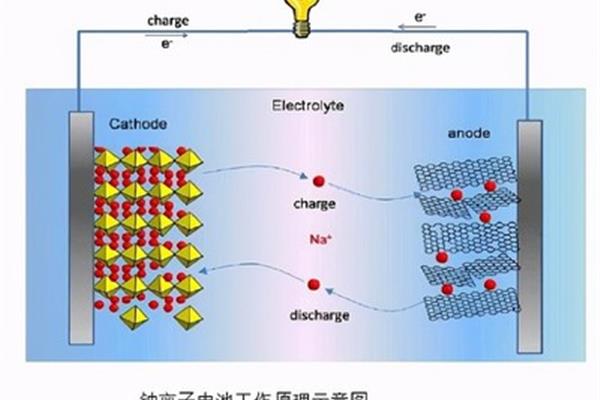
原电池和电解池都是基于电子导体(如金属)和离子导体(如电解质溶液)之间的接触界面上发生的氧化还原反应。原电池形成的条件:1。电极材料由两种金属活性不同的金属或金属与其他导电材料(非金属或某些氧化物等)组成。).2.电解质存在。3.导线连接在两个电极之间以形成闭合回路。4.该反应是自发的氧化还原反应。只要满足前三个条件,就可以形成原电池。
7、原 电池的原理是什么?一次电池阴阳离子移动方向:阳离子向正极移动,阴离子向负极移动。在原电池中,电解质溶液中的阳离子向正极移动,外电路中电子从负极流向正极;内电路(电解质溶液)中的阴离子向负极移动,阳离子向正极移动;电子定向运动形成电流,实现了化学能向电能的转化。电解槽中离子的流向是阴阳相吸,即阳离子流向阴极,阴离子流向阳极,原电池通过氧化还原反应产生电流的装置称为原电池,也可以说是将化学能转化为电能的装置。
![{$DT[sitename]}](/skin/zx123/img/logo.png)