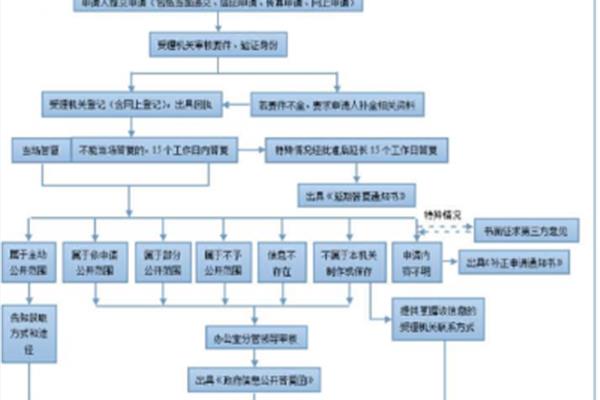
实验室制乙炔 实验室制取乙烯和乙炔的方法?
实验室乙炔生产。乙炔制备的实验室试验场地?实验室乙炔制备实验的采集方法:排水气体采集法,一、乙炔的实验室制备乙炔的实验制备实验反应原理:电石遇水发生剧烈反应,生成氢氧化钙和乙炔气体,实验室生产乙炔的实验装置:采用“固体 液体→气体”生产装置,实验室乙炔生产尾气如何处理!。
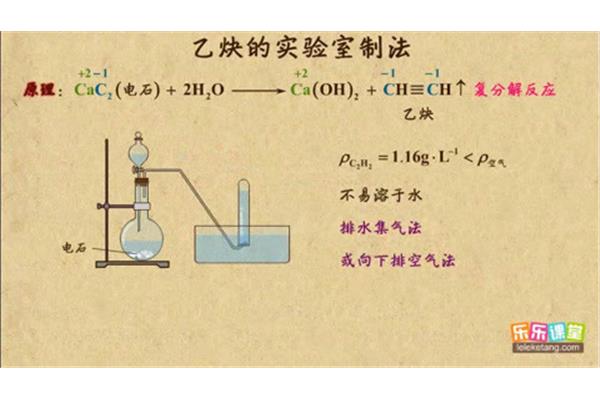
1。实验室制备乙炔实验反应原理:电石遇水发生剧烈反应,生成氢氧化钙和乙炔气体。实验室生产乙炔的实验装置:采用“固体 液体→气体”生产装置。实验室乙炔制备实验的采集方法:排水气体采集法。二、操作及原因:1。加入饱和盐水,避免电石与水过度反应。2.由于电石中常含有杂质,会产生HS和pH值降低的气体,因此常采用CuSO₄去除这些杂质气体。

操作:打开分液漏斗上口,使盐溶液进入烧瓶,与电石反应。现象:烧瓶反应剧烈,试管内出现气泡,溴水或高锰酸钾褪色,乙炔燃烧火焰呈黄色,并伴有黑烟。结论:电石与水反应生成乙炔。乙炔是可还原的。乙炔能燃烧,燃烧时火焰呈黄色。五、考点:1。条件:需要暖气吗?2.药物:电石与饱和盐水反应。为什么要用饱和生理盐水?

首先用排水法收集乙炔。由于乙炔不溶于氢氧化钠,可以在排水装置前加一个装有氢氧化钠的烧杯,吸收乙炔中的杂质(一般为酸性气体如CO2SO2H2S)。用CaC2生产乙炔,要用饱和盐溶液收集乙炔(虽然书上是排干的)。由于CaC2含有P、S等元素,会产生PH3、H2S等气体,这些气体可被NaOH溶液或CuSO4溶液吸收。

考点:1。条件:需要暖气吗?2.药物:电石与饱和盐溶液反应,为什么要用饱和盐溶液?3.杂质去除:硫酸铜溶液去除H2S和其他气体。4.方程式。5.乙炔的检验:KMnO4 _ 4或溴水原理:电石遇水会发生剧烈反应,产生氢氧化钙和乙炔气体。操作和原因:医学1。饱和盐水,避免电石与水反应过于剧烈。2.电石中有杂质,会产生H2S和还原性PH3的气体。CuSO4 _ 4常用于去除这些杂质气体。
4、实验室制乙炔.实验室生产乙炔用饱和盐溶液与电石反应:CAC 2·2 H2 OCA(OH)2 C2 H2↑使用饱和盐溶液是因为如果用蒸馏水,反应会太快,生成的乙炔容易爆炸。饱和盐水的水分少,更安全,1.爆炸性气体通常指可燃气体和空气或氧气的混合物。2.不纯之气也指这种情况,3.如果混合二氧化碳或氮气,不会爆炸。
![{$DT[sitename]}](/skin/zx123/img/logo.png)