锌位于元素周期表的什么区 初中化学元素周期表全部
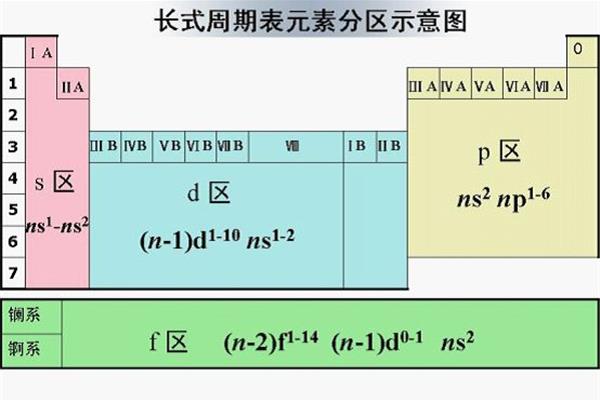
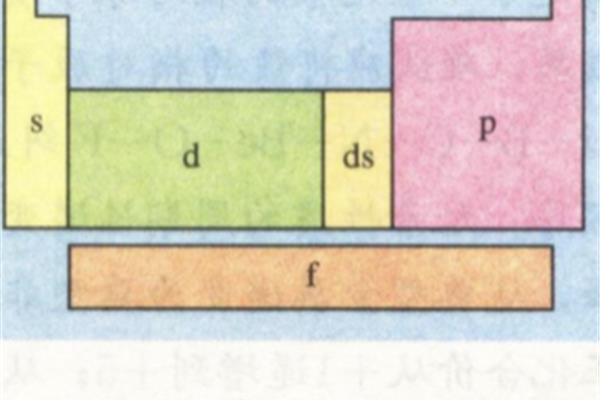
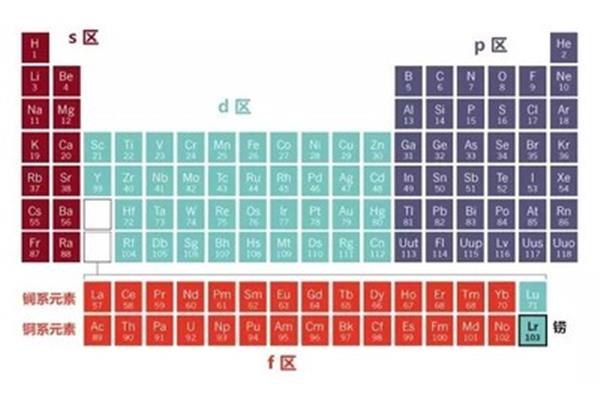
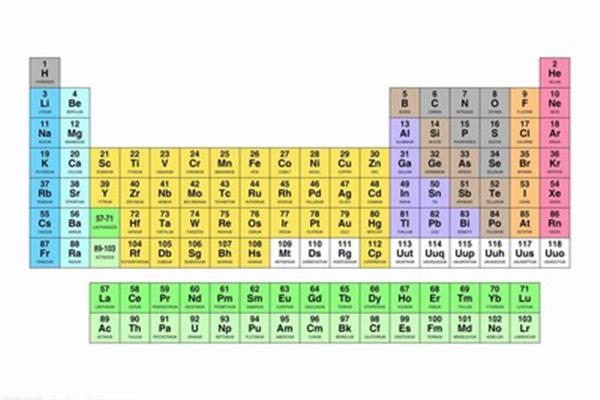
元素周期表的分区是怎么划分的?元素周期表分为几个区域,使得周期表形成元素分区。在元素周期表中,元素周期表的图片如下:化学元素周期表中按照原子顺序从小到大排序的化学元素列表,元素周期表的图片是什么样的?元素周期表中的五个区域是如何划分的?最好有个图元素周期表的分区分为S区,P区,D区,ds区,F区。
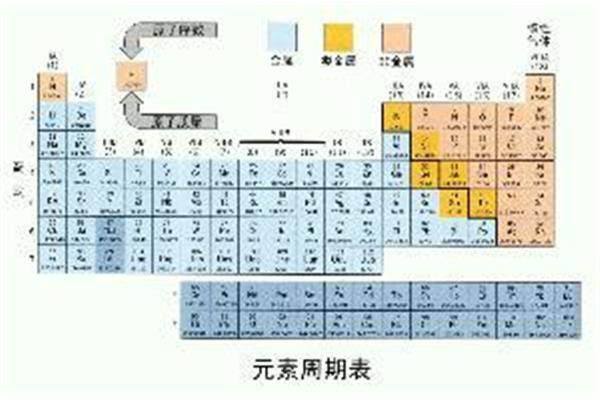
化学元素周期表是按照原子序数从小到大排序的化学元素列表。列表一般是长方形的,有些元素的周期里有空格,这样特征相似的元素就属于同一组,比如碱金属元素、碱土金属、卤族元素、稀有气体等等。这使得元素周期表分为7个主族、7个次族、VIII族和0族。由于元素周期表可以准确地预测各种元素的特性及其相互关系,因此作为分析化学行为的非常有用的框架,被广泛应用于化学和其他科学领域。
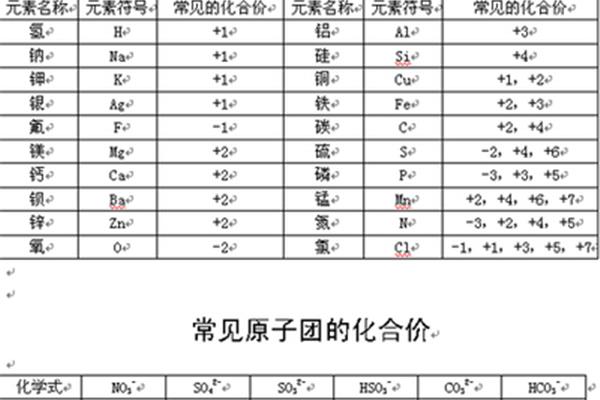
(五、六周期间的分组除外)2。元素化合价(1)除第一周期外,第二周期元素的最高正化合价从碱金属1到氮元素5递增(氟无正化合价,氧无最高正化合价),其他周期元素的最高正化合价从碱金属1到7递增,非金属元素的负化合价从碳族4到1递增。(2)同一主族元素的最高正化合价和最低负化合价相同。

元素/图像-2/1:氢q和qěng;;元素2:氦hàI;3号元素:锂lǐ;4号元素:铍pí;5号元素:硼péng;;元素6:碳tàn;元素7:氮dàn;8号元素:氧y m 4 ng元素9:氟fú;元素10:氖,n,m,I;元素11:钠nà;12号元素:镁m I;元素13:铝l化身;元素14:硅gi;元素15:磷líng;;元素16:硫liú;17号元素:氯卢;18号元素:氩y;19号元素:钾基;元素20:钙gàI;元素21:钪kàng;;22号元素:钛tàI;23号元素:钒fán;24号元素:铬gè;25号元素:锰měng;;26号元素:铁ti;27号元素:钴gū。
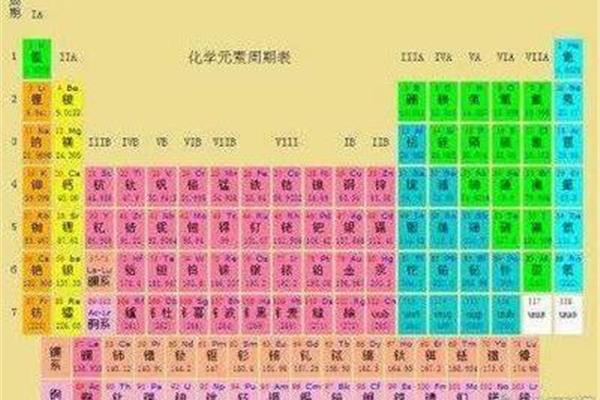
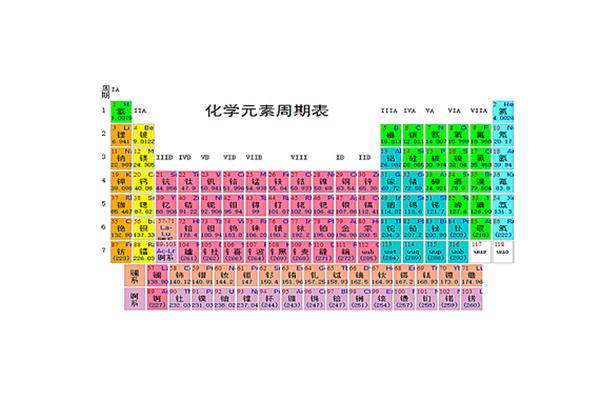
化学元素周期表的排列如下:1。从右边开始减少,从上到下增加。2.元素周期表有7个周期和16个族。每行称为一个句号,每列称为一个族(族VIII包含三列)。这七个时期又可分为短时期(1,2,3)和长时期(4,5,6,7)。3.同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次增加,原子半径减小(零组元素除外)。
4.在同一个家族中,从上到下,最外层的电子数相同,核外电子层数逐渐增加,原子半径增加,原子序数增加,元素的金属性增加,非金属性减少。化学元素周期表是按照原子量从小到大排序的化学元素列表。列表通常是矩形的,在一些元素周期中有空格,因此具有相似特征的元素可以归入同一家族,如碱金属元素、碱土金属、卤族元素、稀有气体、非金属、过渡元素等。

元素周期表的分区分为S区、P区、D区、ds区、F区。元素周期表有7个周期和16个族。每条横线称为一个周期,每条竖线称为一个家族。这七个时期又可分为短时期(1,2,3),长时期(4,5,6)和不完全时期(7)。有16个民族,进一步分为7个主民族(ⅰAⅶAⅷA),7个亚民族(ⅰBⅶBⅷB),1个ⅷ群和1个零群。
元素周期表(拼音版)q长氢,h氦,lǐ Li,p be,p长硼,t长碳,n长氧,f长镁, ②铷s:锶yǐ钇gào锆ní铌m钼dé李o钌l: o铑pá钯yín银gé镉y: n铟x:锡t:锑dí碲di m: n碘xiān氙sè铯bèi钡lán镧sh ƭ铈Cu ƨ错n ǐ钕p ǐ shān Ng Hg tā铊qiān tǔ钍pú ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ ǔ 46
主要是根据价电子的轨道来划分的。S区域是IA和IIA,因为只有ns上的电子会在反应中丢失。P区是IIIA、IVA、VA、VIA和VIIA,价电子位于S轨道和P轨道。ns和np上的电子会在反应中丢失。d是IIIB到VIII,ns和(n1)d上的电子在反应中丢失。ds是IB和IIB。在反应中,ns的电子通常会丢失,但(n1)d的电子也可以不断丢失。ns和(n2)f的电子在F区丢失。但由于长期的屏蔽作用,会更加明显。

La和Ac这两种元素本来应该是先从F排出,再到D,现在只有D有电子,但还是属于F,稀有气体不是按照失去的电子所在的能级来划分的。一般主族是最后一个能级子族,如果Na是1s22s22p64s1,失去的电子在S,所以钠在S,铬1s22s22p63s23p63d54s1,失去的电子在ds。价电子层为ns1或2(n≥1)。
元素周期表的图片如下:化学元素周期表中按照原子顺序从小到大排序的化学元素列表。列表一般是长方形的,有些元素的周期里有空格,这就使得特性相近的元素属于同一组,比如卤素和惰性气体。这就使得周期表形成了一个元素分区。因为周期表可以准确预测各种元素的特性及其关系。因此,它作为分析化学行为的非常有用的框架被广泛地用于化学和其他科学领域。这使得元素周期表分为7个主族、7个次族、VIII族和0族。
(1)ⅰA和ⅱA族最后充满S电子,这就是S区;ⅲ a ~ 0为p区,ⅲ b ~ ⅴ ⅱ b和ⅴ ⅲ为d区;ⅰB族和ⅱB族是ds区,如图,所以答案是:(2)区内第6、7列的某些元素,其D轨道半满,S电子半满或全满,是稳定结构。类似于ds区元素的稳定结构,可以排列在ds区,所以答案是:DS;(3)3)Cr的外围电子组态是3d54s1,是半填充的4s轨道;
(4)第一个周期有2个元素,第二、三个周期有8个元素,第四、五个周期有18个元素,第六、七个周期有32个元素,所以满的时候有118个元素,所以答案是:118;(5)周期表中F的电负性最大。f的原子轨道图显示,氟与水反应生成HF和氧气,反应式为2 f2h2o·═·4hfo 2,所以答案为:f;2F2 2H2O═4HF氧气。。
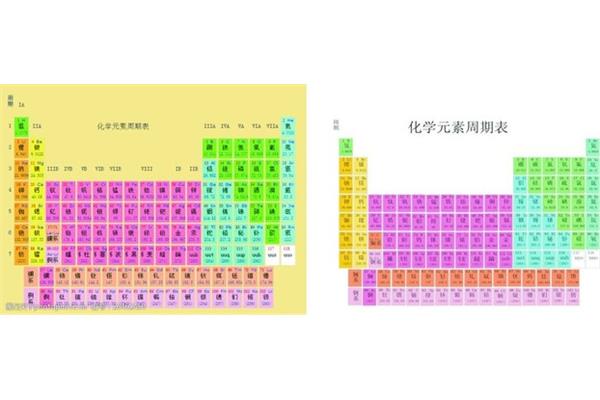
锌是一种化学元素,化学符号为Zn,原子序数为30,位于化学元素周期表的第4周期和IIB族。化学元素周期表是按照原子量从小到大排序的化学元素列表。列表一般是长方形的,有些元素的周期中有空格,这样特征相似的元素就属于同一组,比如碱金属元素、碱土金属、卤族元素、稀有气体、非金属和过渡元素。这使得元素周期表分为7个主族、7个次族、8族和18族。

俄罗斯化学家德米特里·伊万诺维奇·门捷列夫在1869年总结并出版了这个周期表(第一代元素周期表)。此后出现了170多种类型的周期表,可归纳为:短表(以门捷列夫为代表)、长表(以维尔纳为代表)、超长表(以波尔塔为代表);平面螺旋表和圆形表(以Damkoff型为代表);三维周期表(以莱西的锥柱三维表为代表)等多种类型的表。
9、元素周期表分区是如何划分的?period:一行是周期族;一列为一组,分为主族、子族、0族、VIII族。注意VIII按照价电子构型分为三列:ia ~ II ANS(1 ~ 2)IIB ~ VI IBN1D(1 ~ 5)NS(1 ~ 2)III VN1D(6 ~ 8)NS(2)IB ~ II BN1D(10)NS(1 ~ 2)IIA ~ 0,镧系锕系元素是比较特殊的原子,其核外电子构型原理处于稳定状态,核外电子会尽量按照能量最低原理排列。另外,因为电子不可能都挤在一起,所以也要遵守泡利不相容原理和亨特法则,一般来说,在这三条规则的指导下,可以推导出元素原子的核外电子构型,中学要求的前36种元素也不例外。
![{$DT[sitename]}](/skin/zx123/img/logo.png)